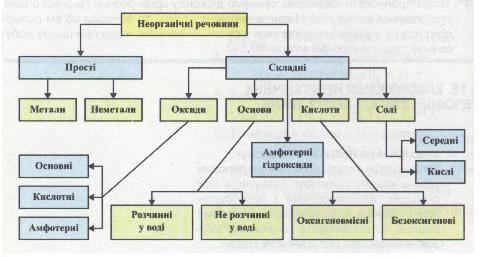
Оксиди, основи, кислоти, солі
Пригадайте їх визначеннямй розподіліть за класами сполук, назвіть речовини:
Серед неорганічних сполук переважають представники саме цих класів. Хоча, окрім них є амфотерні гідроксиди (алюміній гідроксид, цинк гідроксид та ін.), пероксиди (гідроген пероксид та ін.).
Речовини, формули яких ви віднесли до одного класу, подібні за складом, проте мають відмінності щодофізичних і хімічних властивостей. Це дає підстави для їх класифікації на окремі групи. Так, за агрегатним станом (фізична характеристика) оксиди поділяють на тверді (наприклад, фосфор(У) оксид), рідкі (наприклад, вода), газуваті (наприклад, карбон(ІV) оксид).
Наведіть власні приклади оксидів, що за звичайних умов перебувають у різному агрегатному стані.
За здатністю розчинятися у воді кислоти, основи та солі поділяють на розчинні, малорозчинні й нерозчинні. Наприклад, сульфатна кислота добре розчинна, силікатна кислота — нерозчинна, купрум(ІІ) гідроксид — нерозчинна основа, натрій гідроксид -розчинна основа, або луг, кальцій гідроксид — малорозчинна основа, натрій хлорид — розчинна сіль, барій сульфат — нерозчинна сіль, кальцій сульфат — малорозчинна сіль. Потрібно пам'ятати, що абсолютно нерозчинних речовин не існує.
Розчинні основи утворюють милкі на дотик розчини, через що ці речовини дістали назву луги. Це - літій гідроксид, калій гідроксид, кальцій гідроксид, барій гідроксид і деякі інші, їх значно менше, аніж нерозчинних основ
Оксиди. Вам відомо, що оксиди — сполуки, що містять два елемента, один із яких Оксиген.Розчинні основи утворюють милкі на дотик розчини, через що ці речовини дістали назву луги. Це - літій гідроксид, калій гідроксид, кальцій гідроксид, барій гідроксид і деякі інші, їх значно менше, аніж нерозчинних основ
З-поміж різних класифікацій неорганічних речовин найуживанішою є класифікація за хімічними властивостями.
Оксиди бувають солетвірні й несолетвірні.
Солетвірні на підставі їх хімічних властивостей поділяють на основні, кислотні й амфотерні.
Основні оксиди — це оксиди, яким відповідають основи. При взаємодії з кислотами основні оксиди утворюють сіль та воду.
До них належать лише оксиди металічних елементів зі ступенем окиснення +1, +2, рідше +3.(З валентностями І, ІІ та рідко ІІІ)
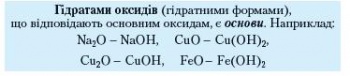
Кислотні оксиди — це оксиди, яким відповідають кислоти. Кислотні оксиди при взаємодії з лугами утворюють сіль та воду.
До них належать усі солетвірні оксиди неметалічних елементів та оксиди деяких металічних елементів із високими валентностями ( IV, V, VI, VII ).
Щодо кислотних оксидів і відповідних їм гідратів оксидів (оксигеновмісних кислот), то для них також справджується закономірність, виявлена для основ: атоми кислототвірних елементів у кислотному оксиді й відповідній йому кислоті мають однакові валентності.
Напишіть формули сульфур(ІУ) оксиду і сульфур(УІ) оксиду та формули відповідних їм гідратів оксидів (кислот).
Амфотерні оксиди — оксиди, які можуть виявляти властивості як кислотних так і основних оксидів, тобто можуть утворювати сіль і воду при взаємодії як із кислотою, так і з лугом.
До них належить невелика кількість оксидів металічних елементів:
Кислоти. Кислоти належать до складних речовин, загальну формулу яких передає об'ємне зображення:
У розчинах кислот наявні катіони Гідрогену, що зумовлюють загальні властивості кислот. Так, кислоти взаємодіють з:
- індикаторами;
- металами (розташованими в ряді активності до водню);
- основними й амфотерними оксидами;
- основами й амфотерними гідроксидами;
- солями інших кислот, якщо один із продуктів реакції випадає в осад або виділяється в газоподібному стані.
- Катіони Гідрогену зумовлюють загальні властивості кислот,
- кислотні залишки — специфічні властивості кислот.
Основи. Основи належать до складних речовин, загальну формулу яких передає об'ємне зображення:
Наявність гідроксид-іонів зумовлює загальні властивості лугів:
Наявність гідроксид-іонів зумовлює загальні властивості лугів:
- дію на індикатори;
- взаємодію з кислотними та амфотерними оксидами;
- взаємодію з кислотами (реакція нейтралізації);
- взаємодію з амфотерними гідроксидами;
- взаємодію із солями, якщо один із продуктів реакції випадає в осад або виділяється в газоподібному стані.
Для нерозчинних основ характерною є взаємодія:
- з кислотними та амфотерними оксидами (при сплавлянні у твердому стані);
- з кислотами;
- розкладання під час нагрівання.
Солі. Солі належать до складних речовин, загальну формулу яких передає об'ємне зображення:
Як бачимо, до складу солей, як і до складу основ, входять катіони металічних елементів, а інша складова частина солей — аніони кислотних залишків — властива також молекулам відповідних кислот. Таке поєднання йонів урізноманітнює хімічні властивості солей.
Солі взаємодіють з:
- металами, активнішими від металу, йони якого входять до складу солі (у розчині);
- лугами (у розчині за умови утворення осаду);
- іншою сіллю (у розчині за умови утворення осаду);
- кислотами, що є сильнішими електролітами за кислоту, із сіллю якої проводять реакцію (за умови утворення осаду чи виділення газу);
- розкладання солей деяких кислот (наприклад, карбонатів, нітратів) під час нагрівання.
Номенклатура неорганічних сполук.
Окрім правильного запису хімічних формул і рівнянь хімічних реакцій, не менш важливо правильно називати речовини. Ви вже обізнані із сучасною українською хімічною номенклатурою, повторити яку допоможе таблиця 1. При повторенні треба пам'ятати, що для оксидів, основ і солей існує загальне правило номенклатури.
Усі назви складаються із двох слів. Назву елемента, з атомів якого утворилася перша складова частина речовини, пишуть з малої літери в називному відмінку, а в разі прояву ним змінної валентності її без відступу зазначають після назви елемента в круглих дужках римською цифрою.
Особливості перебігу хімічних реакцій неорганічних речовин у розчинах. Значна частина хімічних реакцій між неорганічними речовинами відбувається в розчині.







Немає коментарів:
Дописати коментар